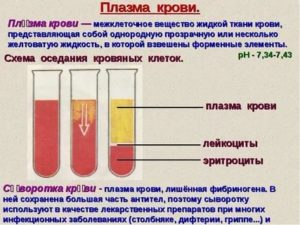
Физиология механизма свёртывания крови при повреждении сосудистой системы организма
Содержание:
- Как избавиться от тромба
- Примечания
- Виды и механизмы
- Нарушение функционирования первичного гемостаза
- Тромбоциты, роль в тромбоцитарно-сосудистом гемостазе
- Методы оценки функции тромбоцитов
- Процесс свёртывания крови
- Патология системы
- Определение гемостаза
- Время свертывания крови в норме
- Система свертывания крови и фибринолиза
- Предназначение обследований
Как избавиться от тромба
Опытные врачи знают не только стадии формирования тромбов, но и методы лечения больных. До этого обязательно проводится обследование (допплерография, УЗИ, общие анализы, коагулограмма, ангиография, функциональные пробы). Для лечения больных используются препараты, которые разжижают кровь, растворяют образовавшиеся тромбы и устраняют отек и боль.
К ним относятся Варфарин, Фрагмин, Клексан, Гепарин. Прямые антикоагулянты вводятся внутривенно или подкожно. Доза устанавливается лечащим врачом. Против тромбов эффективны тромболитики (Стрептокиназа). Часто назначаются препараты, которые увеличивают объем циркулирующей крови (Реополиглюкин).
Если на стадии тромбообразования появляется боль, то используются противовоспалительные лекарства из группы НПВС (Кетопрофен, Диклофенак). При поверхностном тромбозе в схему лечения включают различные местные средства (мази, гели, растворы). Хорошо зарекомендовал себя гель Троксевазин. В случае развития тромбофлебита могут понадобиться жаропонижающие препараты.
Если имеются симптомы не только тромбоза, но и варикоза, назначаются медикаменты, которые улучшают состояние стенки вен. При развитии тяжелого тромбофлебита, продвижения тромба и риске его отрыва требуется радикальное лечение (операция).
Примечания
- ↑ Кузник Б. И. 6.4 Система гемостаза // Физиология человека / Под редакцией В. М. Покровского, Г. Ф. Коротько. — М.: Медицина, 2000. — Т. 1. — С. 313—325. — 448 с. — 3000 экз. — ISBN 5-225-00960-3.
- ↑ Вайс Х., Елькманн В. Глава 18. Функции крови. Раздел 6. Остановка кровотечения и свёртывание крови // Физиология человека / Под редакцией Р. Шмидта и Г. Тевса. — М.: Мир, 1996. — Т. 2. — С. 431—439. — ISBN 5-03-002544-8.
- . Дата обращения 15 ноября 2012.
- Пантелеев М. А., Васильев С. А., Синауридзе Е. И., Воробьёв А. И., Атауллаханов Ф. И. Практическая коагулология / Под ред. А. И. Воробьёва. — М.: Практическая медицина, 2011. — 192 с. — ISBN 978-5-98811-165-8.
Виды и механизмы
Классифицируют три вида гемостаза, которые по сути представляют его этапы:
- сосудисто-тромбоцитарный;
- коагуляционный,
- фибринолиз.
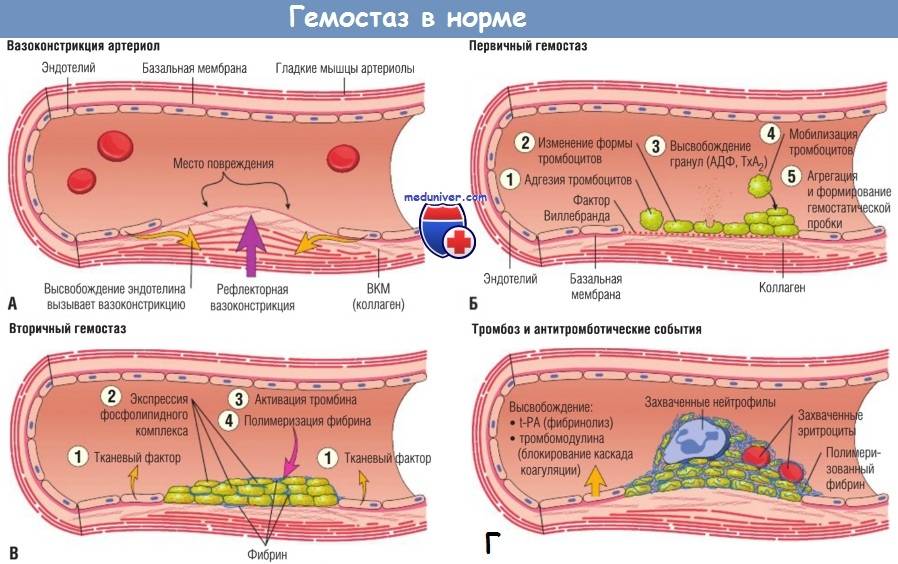
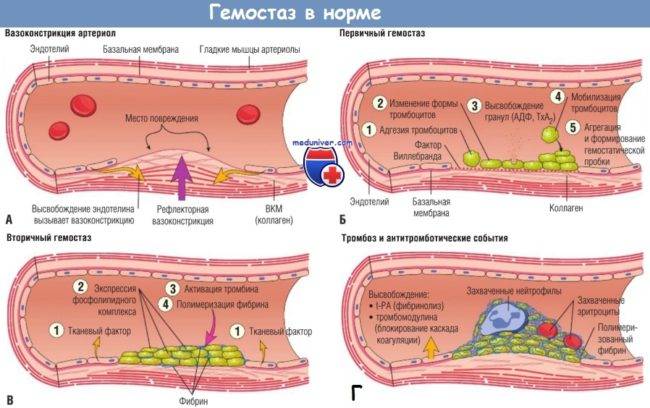 Схема гемостаза человека в норме и при нарушениях
Схема гемостаза человека в норме и при нарушениях
В зависимости от интенсивности кровотечения, в процессе формирования тромба превалирует один из них, несмотря на то, что все три разновидности начинают работать одновременно. Они существуют в состоянии непрерывного взаимодействия, дополняя друг друга от самого начала формирования тромба до его растворения.
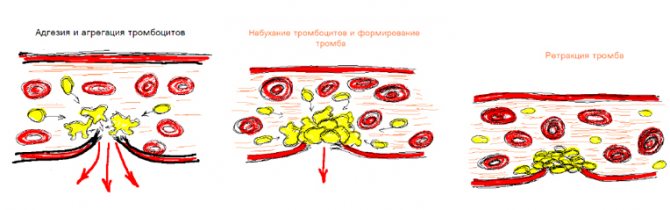
- Первичный (сосудисто-тромбоцитарный) гемостаз развивается постепенно:
- повреждение сосуда приводит к сокращению его стенок, благодаря чему через 30 секунд кровотечение приостанавливается;
- к повреждённому участку эндотелия направляются и прикрепляются тромбоциты;
- формируется обратное скопление тромбоцитов. Они изменяют форму, благодаря чему «склеиваются» друг с другом и налипают на сосудистую стенку. Образуется первичный, или «белый» (бесцветный) тромб. Под воздействием тромбина склеивание носит необратимый характер;
- образуется гемостатическая пробка, которая отличается от сгустка крови тем, что не содержит элементов фибрина. На её поверхности скапливаются факторы свёртывания плазмы. Они дают старт внутренним процессам коагуляционного гемостаза, который завершается образованием фибриновых нитей. На основе пробки образуется плотный тромб. При отдельных патологиях (инфаркте миокарда, инсульте) факт тромбообразования может стать причиной серьёзных осложнений, если перекрывает питание жизненно важных органов. В таких случаях врачи применяют специальные лекарственные средства.
- Вторичный (коагуляционный) гемостаз прекращает кровопотерю в тех сосудах, где первичного недостаточно. Он длится две минуты и по сути представляет реакцию между белками плазмы, в результате чего формируются фибриновые нити. Этот приводит к остановке кровотечения из нарушенного сосуда и даёт возможность не опасаться рецидива в ближайшее время. Вторичный гемостаз может быть активирован двумя способами:
- внешним, когда в кровь поступает тканевый тромбопластин как результат взаимодействие коллагена с фактором свёртывания в месте повреждения сосудистой стенки;
- внутренним. Если тромбопластин не поступает извне, процесс запускается тканевыми факторами. Внутренний и внешний механизмы взаимосвязаны благодаря кинин-калликреиновым белкам.
- Фибринолиз. Он отвечает за реструктуризацию фибриновых нитей на растворимые сочетания, восстановление проходимости сосуда, поддержку оптимальной вязкости крови. Кроме того, использует способность лейкоцитов по уничтожению патогенов, устраняет тромбоз.
Помимо перечисленных разновидностей, классифицируют:
- Гормональный гемостаз, который представляет основу лечения дисфункциональных маточных кровотечений (ЖМК) у женщин любого возраста. Он предполагает использование гормональных средств, например, таблеток, применяемых для оральной контрацепции.
- Эндоскопический гемостаз — комплекс особых мер для остановки длящихся кровотечений. Среди его способов: механический, физический и медикаментозный. Каждый из них, в свою очередь, состоит из набора различных процедур, в зависимости от характера кровопотери. При этом различают:
- временный гемостаз — предварительную остановку кровотечения, которую врачи выполняют экстренно, на месте происшествия;
- окончательный гемостаз, производимый уже в стационаре.
- Плазменный гемостаз — последовательность преобразований, которые происходят в плазме крови при участии 13 факторов свёртывания.
Главной конечной целью всех видов и способов гемостаза является прекращения процесса кровотечения.
Нарушение функционирования первичного гемостаза
В большинстве случаев патология, связанная с нарушением в работе сосудисто-тромбоцитарного гемостаза, вызвана изменениями в синтезе одного из рецепторов, расположенного на поверхности тромбоцитарной мембраны.
 Врожденные формы пониженной свертываемости крови развиваются вследствие нарушенного процесса адгезии тромбоцитов
Врожденные формы пониженной свертываемости крови развиваются вследствие нарушенного процесса адгезии тромбоцитов
- Синдром Бернара-Сулье. Наследственная геморрагическая дистрофия тромбоцитов, когда на мембране отсутствуют рецепторы, необходимые для присоединения фактора Виллебранда.
- Тромбастения Гланцмана-Негли. На поверхности тромбоцитов отсутствует специальный белок, что приводит к невозможности клеток контактировать между собой, вследствие чего они не стягивают место дефекта.
Синдром Ослера
Врожденное генетическое заболевание сопровождается разрушением сосудистой стенки в результате сниженного количества коллагена в организм, что приводит к уменьшению адгезии тромбоцитов. Болезнь проявляется образованием на коже и слизистых оболочках ангиоэктазий после перенесенной механической травмы.
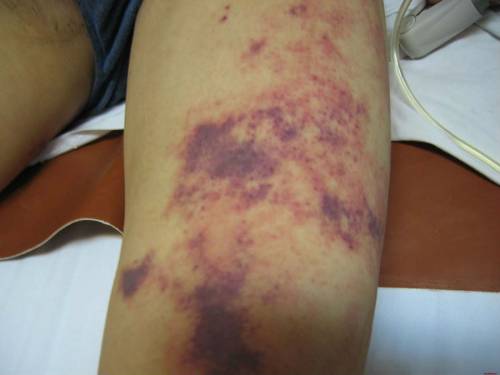 Заболевание Ослера сопровождается кровоизлияниями, по характеру схожими с гематомой
Заболевание Ослера сопровождается кровоизлияниями, по характеру схожими с гематомой
Макроцитарная тромбоцитодистрофия
Наследственная патология, которая заключается в отсутствии рецептов к гликопротеину плазмы крови, из-за чего поверхности кровяных клеток не взаимодействуют между собой. В клинической картине наблюдаются кровотечения из пищеварительного тракта, кровоточивость, образование гематом при незначительных механических повреждениях.
Заболевание Гланцмана
Генетическое нарушение развивается на фоне функционального расстройства тромбоцита. Причиной патологии является отсутствие рецепторов на мембране к фибриногену.
Характеристика клинической картины:
- Повышенная проницаемость сосудистой стенки, из-за чего наблюдаются частые кровотечения.
- Значительно удлиняется время кровотечения.
- Появление петехий в местах повреждений.
У новорожденных нарушение первичного звена гемостаза развивается на фоне несовместимости матери и ребенка по тромбоцитарному антигену или рождение детей от женщины, страдающей системными заболеваниями, и после проведенной спленэктомии.
Тромбоциты, роль в тромбоцитарно-сосудистом гемостазе
Тромбоциты или пластинки образуются в красном костном мозге гигантскими многоядерными клетками – мегакариоцитами, от цитоплазмы которых они отшнуровываются в виде округлых или овальных плоских дисков, диаметром от 2 до 4 мкм. Это безъядерные гранулоциты. Продолжительность жизни тромбоцитов человека составляет 7-10 дней. После выхода из костного мозга они циркулируют в крови и частично депонируются в селезенке и печени (около 20-25% всех клеток), откуда происходит их вторичный выход в кровоток. В крови здоровых людей содержится 170-350х109/л тромбоцитов. Уменьшение количества тромбоцитов до 80×109/л способствует появлению кровоточивости, риск которой резко возрастает при уровне тромбоцитов ниже 20×109/л, а увеличение выше 800×109/л создает угрозу развития тромбозов.
В гиалоплазме тромбоцитов содержится два типа гранул (табл.1).
Таблица 1 – Компоненты гранул тромбоцитов, определяющих участие тромбоцитов в тромбоцитарно-сосудистом гемостазе
| δ-гранулы (электронно-плотные) | Альфа гранулы | |
| Компонент (Р) | Функция | |
| АДФ –активация тромбоцитов | Тромбоцитарный фактор роста | Репарация за счет активации деления фибробластов |
| Трансформирующий фактор роста β (ТФР-β) | Контроль репарация ткани | |
| Ca2+- активация тромбоцитов | Тромбоцитарный фактор 4 (ТФ-4) | Нейтрализация гепарина |
| Mg2+ –активация тромбоцитов | β-тромбоглобулин (β-ТГ) | Воспаление, репарация ткани |
| Фактор Виллебранда (ФВ) | Адгезия тромбоцитов, носитель ф.VIII | |
| Тромбоспондины (TSP-l, TSP- 2)* | Адгезия и агрегация тромбоцитов | |
| Серотонин –дилатация артериол | Фибриноген | Свертывание крови, адгезия и агрегация тромбоцитов |
| Фактор V | Свертывание | |
| Адреналин – спазм поврежденного сосуда | Протеин S | Антикоагулянт |
| ДОФА спазм поврежденного сосуда | ||
| Альбумин | Связывание гормонов, токсинов, лекарств | |
| Иммуноглобулины | Иммунитет |
*Тромбоспондин (TSP-l) – гликопротеид с м.м. 165 кДа. Наибольшее количество TSP-1 представлено в α-гранулах тромбоцитов и секретируется в плазму в ответ на их активацию гормонами и цитокинами. Известно множество биологических реакций, инициируемых TSP-1: ангиогенез, апоптоз, регуляция иммунного ответа. TSP-1 образует комплексы с коллагеном, гепарином, опосредует адгезию тромбоцитов к субэндотелию.
Тромбоспондин-2 (TSP-2) – белок семейства тромбоспондинов с м.м. 150 кДа. Аналогично TSP-1, он вызывает множество биологических реакций: пролиферацию, агрегацию, клеточную подвижность, ангиогенез, заживление ран. TSP-2 регулирует формирование коллагенового матрикса, воздействуя на функцию фибробластов. Также TSP-2 обеспечивает взаимодействие клеток с экстрацеллюлярным матриксом, что можно отнести к его основной функции.
Из всех перечисленных факторов специфическими для гранул тромбоцитов являются два: ТФ4 – антигепариновый фактор и тромбоглобулин, определение которых в плазме крови используют как ранние надежные маркеры активации тромбоцитов.
Регуляция функций тромбоцитов осуществляется, как и всех клеток организма, путем взаимодействия регуляторных молекул (лигандов) с рецепторами их мембран – гликопротеинами (табл. 2).
Таблица 2 – Рецепторы тромбоцитов и их лиганды
| Гликопротеин | Лиганды | |
| Первичные | Вторичные | |
| GP IIb-IIIa | Фибриноген | Фактор Виллебранда, фибронектин, витронектин, фибриноген |
| GP Ib-IX | Фактор Виллебранда | Тромбин |
| GP Ia-IIa | Коллаген | |
| GP Ic-IIa | Фибронектин* | |
| Рецептор витронектина | Витронектин** | Тромбосподин |
*Фибронектин (ФН) – гликопротеин с высокой м.м., состоящий из двух практически идентичных полипептидных цепей (каждая по 220 кДа). Он синтезируется и секретируется печенью, нормальная концентрация циркулирующего ФН в кровотоке составляет примерно 330 мкг/мл плазмы. ФН принадлежит к семейству адгезивных белков внеклеточного матрикса. Димерная структура позволяет ему функционировать как молекулярный клей, соединяющий различные молекулы. Плазменный ФН выполняет важную роль в воспалительных, регенеративных процессах и механизмах гемостаза.
**Витронектин (ВН) – полифункциональный гликопротеин (м.м. 78 кДа), компонент крови и внеклеточного матрикса, выполняет функции аналогичные ФН. ВН синтезируется в печени, нормальная концентрация в плазме составляет 250-450 мкг/мл. ВН взаимодействует с комплементом, гепарином, комплексом тромбин-антитромбин.
Методы оценки функции тромбоцитов
Оценка первичного гемостаза заключается в определении следующих диагностических методов:
- Манжетная проба. Позволяет выявить степень ломкости сосудов. Путем дозированного повышения венозного давления на поверхности предплечья образуются петехии в количестве не более 10.
- Метод Айви. Позволяет оценить время свертываемости крови. Кожу верхней трети предплечья прокалывают, в норме кровь сворачивается в течение 5–8 минут.
- Проба Дьюка. Определение скорости свертывания крови при помощи прокола мочки уха, в норме – 2–4 минуты.
- Агрегация тромбоцитов. Оценка начальной стадии формирования тромба.
- Фотоэлектроколориметрия с применением агрегометра. Определяет уровень фактора Виллебранда в плазме.
- Степень ретракции кровяного сгустка.
 Методы исследования свойств и структуры тромбоцитов позволяют уточнить характер патологии
Методы исследования свойств и структуры тромбоцитов позволяют уточнить характер патологии
Сниженное количество тромбоцитов в крови приводит к неполноценному функционированию эндотелия, вследствие чего повышается ломкость капилляров. Параллельно происходит нарушение адгезивной и агрегационной функции тромбоцитов, что способствует усилению и удлинению времени кровотечения при повреждении сосудов.
Повышенный уровень тромбоцитов и увеличение их вязкости приводит к развитию тромбоза, инфаркта миокарда, ишемии и облитерирующим болезням сосудов конечностей.
Первичное звено гемостаза является важным этапом в остановке кровотечения. Так, при травмах микрососудов компенсаторный механизм включается в первые секунды и продолжается до полной остановки кровопотери. Однако нарушение функций тромбоцитов приводит к дисбалансу в организме, что выявляется различными патологическими состояниями.
Процесс свёртывания крови
Классическая схема свёртывания крови по Моравицу (1905 год)
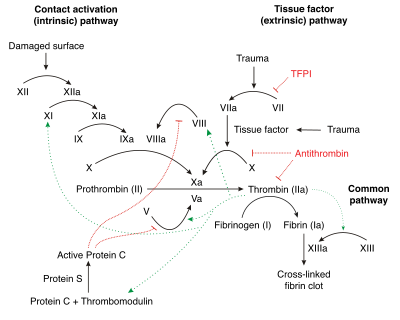
Схема взаимодействия факторов свёртывания крови
Процесс свёртывания крови представляет собой преимущественно проферментно-ферментный каскад, в котором проферменты, переходя в активное состояние, приобретают способность активировать другие факторы свёртывания крови.
В самом простом виде процесс свёртывания крови может быть разделён на три фазы:
- фаза активации включает комплекс последовательных реакций, приводящих к образованию протромбиназы и переходу протромбина в тромбин;
- фаза коагуляции — образование фибрина из фибриногена;
- фаза ретракции — образование плотного фибринового сгустка.
Данная схема была описана ещё в 1905 году Моравицем и до сих пор не утратила своей актуальности.
В области детального понимания процесса свёртывания крови с 1905 года произошёл значительный прогресс. Открыты десятки новых белков и реакций, участвующих в процессе свёртывания крови, который имеет каскадный характер. Сложность этой системы обусловлена необходимостью регуляции данного процесса.
Современное представление с позиций физиологии каскада реакций, сопровождающих свёртывание крови, представлено на рис. 2 и 3.
Вследствие разрушения тканевых клеток и активации тромбоцитов высвобождаются белки фосфолипопротеины, которые вместе с факторами плазмы Xa и Va, а также ионами Ca2+ образуют ферментный комплекс, который активирует протромбин. Если процесс свёртывания начинается под действием фосфолипопротеинов, выделяемых из клеток повреждённых сосудов или соединительной ткани, речь идёт о внешней системе свёртывания крови (внешний путь активации свёртывания, или путь тканевого фактора). Основными компонентами этого пути являются 2 белка: фактор VIIа и тканевый фактор, комплекс этих 2 белков называют также комплексом внешней теназы.
Если же инициация происходит под влиянием факторов свёртывания, присутствующих в плазме, используют термин внутренняя система свёртывания. Комплекс факторов IXа и VIIIa, формирующийся на поверхности активированных тромбоцитов, называют внутренней теназой. Таким образом, фактор X может активироваться как комплексом VIIa—TF (внешняя теназа), так и комплексом IXa—VIIIa (внутренняя теназа). Внешняя и внутренняя системы свёртывания крови дополняют друг друга.
В процессе адгезии форма тромбоцитов меняется — они становятся округлыми клетками с шиповидными отростками. Под влиянием АДФ (частично выделяется из повреждённых клеток) и адреналина способность тромбоцитов к агрегации повышается. При этом из них выделяются серотонин, катехоламины и ряд других веществ. Под их влиянием происходит сужение просвета повреждённых сосудов, возникает функциональная ишемия. В конечном итоге сосуды перекрываются массой тромбоцитов, прилипших к краям коллагеновых волокон по краям раны.
На этой стадии гемостаза под действием тканевого тромбопластина образуется тромбин. Именно он инициирует необратимую агрегацию тромбоцитов. Реагируя со специфическими рецепторами в мембране тромбоцитов, тромбин вызывает фосфорилирование внутриклеточных белков и высвобождение ионов Ca2+.
При наличии в крови ионов кальция под действием тромбина происходит полимеризация растворимого фибриногена (см. фибрин) и образование бесструктурной сети волокон нерастворимого фибрина. Начиная с этого момента в этих нитях начинают фильтроваться форменные элементы крови, создавая дополнительную жёсткость всей системе, и через некоторое время образуя тромбоцитарно-фибриновый сгусток (физиологический тромб), который закупоривает место разрыва, с одной стороны, предотвращая потерю крови, а с другой — блокируя поступление в кровь внешних веществ и микроорганизмов.
На свёртывание крови влияет множество условий. Например, катионы ускоряют процесс, а анионы — замедляют. Кроме того, существуют вещества как полностью блокирующие свёртывание крови (гепарин, гирудин и другие), так и активирующие его (яд гюрзы, феракрил).
Врождённые нарушения системы свёртывания крови называют гемофилией.
Патология системы
Патофизиология системы позволяет выявлять в ней существующие патологии еще до появления симптомов болезни.
У женщин в период беременности анализ крови позволяет своевременно выявить нарушения кровоснабжения плаценты, предотвратить выкидыш или замирание плода из-за тромбоза сосудов матки. Поэтому полное исследование гемостаза и определение показателей крови необходимо проводить как минимум раз в три месяца.
Расстройство системы может быть вызвано инфекционными болезнями, тромбофилией, гемофилией, заболеваниями печени, аутоимунными болезнями, новообразованиями, приемом некоторых лекарственных препаратов. Определить истинную причину нарушения свертываемости крови можно при помощи дополнительных анализов.
Определение гемостаза
Кровь выполняет несколько жизненно важных функций, в том числе — транспортную. Благодаря разветвленной системе кровообращения каждая клетка постоянно получает кислород, необходимые ей питательные вещества и отдает продукты обмена. Стоит лишить клетки головного мозга притока обогащенной кислородом крови на 30 секунд, и сознание может нарушиться. Чтобы все ткани и органы работали слаженно, кровь, насыщенная кислородом, должна постоянно, неуклонно двигаться по артериям на периферию и по венам — обратно, к сердцу.
Любые преграды на ее пути, например, атеросклеротические бляшки, тромбы или повреждения сосудов сопряжены с риском для здоровья или жизни. Предотвратить их образование, обеспечить беспрепятственное проникновение крови к каждой клетке помогает мудрая и сложная система — гемостаз.
Гемостаз с древнегреческого языка можно перевести как «остановка крови».
Кровь циркулирует в замкнутой системе под давлением. Система гемостаза поддерживает ее жидкое состояние, останавливает кровотечение, если сосуд поврежден, таким образом сохраняя баланс между свертывающей и противосвертывающей активностью.
Время свертывания крови в норме
Существует ряд методов определения время коагуляции. Для применения способа по Сухареву, каплю крови помещают в пробирку и ждут, когда она выпадет в осадок. При отсутствии патологии, продолжительность свертывания составляет 30 – 120 секунд.
Свертываемость по Дуке определяют следующим образом: производят прокол мочки уха и через 15 секунд промокают область прокола специальной бумагой. Когда кровь не будет появляться на бумаге, значит коагуляция произошла. В норме время свертывания по Дуке от 60 до 180 секунд.
При определении свертывания венозной крови пользуются методикой Ли-Уайта. Необходимо набрать 1 мл крови из вены и поместить в пробирку, наклонить под углом 50°. Проба заканчивается, когда кровь не вытекает из колбы. В норме продолжительность свертывания не должна превышать 4-6 минут.
Время свертывания может увеличиваться при геморрагическом диатезе, врожденной гемофилии, недостаточном количестве тромбоцитов, при развитии диссеминированного внутрисосудистого свертывания и других заболеваниях.
Система свертывания крови и фибринолиза

Это единая система, которая выполняет следующие функции:
1) Поддержание крови в сосудах в жидком состоянии.
2) Осуществление гемостаза (предотвращение больших кровопотерь).
Гемостаз – сложный ферментативный процесс, в результате которого образуется кровяной сгусток.
Гемостаз включает 3 взаимосвязанных друг с другом механизма:
Сосудисто-тромбоцитарный механизм
Коагуляцинный механизм
Ретракция тромба
Сосудисто-тромбоцитарный механизм активируется в течение первой минуты после повреждения сосуда. В области повреждения сосуда скапливаются тромбоциты и прилипают к эндотелию по краям раны. Существуют 2 механизма адгезии тромбоцитов.
1) Поверхность мембраны поврежденного эндотелия приобретает положительный заряд. Поэтому к ней прилипают тромбоциты, наружная поверхность которых заряжена отрицательно. 2) Повреждение сосуда приводит к образованию свободного фактора Виллебранда (в норме он ассоциирован с фактором VIII).
Фактор Виллебранда образует мостики между субэндотелиальными структурами и белками поверхности тромбоцита.
Адгезия тромбоцитов приводит к их активации. Активированные тромбоциты секретируют серотонин, катехоламины, АДФ. Серотонин оказывает сосудосуживающее действие.
Под влиянием АДФ тромбоциты скучиваются и образуют рыхлую тромбоцитарную пробку, проницаемую для плазмы крови.
Образующийся к этому времени в плазме крови тромбин действует на рецепторы тромбоцитов и приводит к их разрушению и слиянию в плотную массу. Образовавшаяся тромбоцитарная пробка непроницаема для плазмы крови.
Коагуляционный механизм активируется в течение нескольких минут после повреждения сосуда. Процесс коагуляции состоит в том, что жидкая плазма крови превращается в плотный гель на основе белка фибрина. Образовавшийся гелевый сгусток усиливает тромбоцитарную пробку.
Ретракция тромба – сжатие сгустка за счет волокон фибрина и тромбоцитарного тромбостенина. За счет ретракции происходит уплотнение сгустка и стягивание краев раны.
Компоненты системы свертывания крови принято называть “факторами”. Факторы бывают тканевыми, плазменными и тромбоцитарными. Тканевые и плазменные факторы обозначаются римскими цифрами, а тромбоцитарные – арабскими. Если фактор является активным, то за цифрой ставится буква “а”. Например, переход неактивного двенадцатого фактора в активный можно обозначить так: фXII —-> фXIIa
Большинство белков системы свертывания крови обладает ферментативной активностью. Все факторы свертывания крови, кроме фXIII, являются сериновыми протеиназами, которые катализируют реакции ограниченного протеолиза.
В ходе реакций свертывания крови все белки-ферменты сначала выступают в роли субстрата, а затем – в роли фермента. Среди белков, участвующих в свертывании крови, есть такие, которые не обладают ферментативной активностью, но специфически ускоряют протекание ферментативной реакции. Они называются параферментами. Это фV и фVIII.
В циркулирующей крови содержатся проферменты протеолитических ферментов: фактор VII (проконвертин), фактор IX ( фактор Кристмаса), фактор Х (Стюарта) и фактор П (протромбин).
Проферменты активируются и их действие направлено на протекание прямой реакции свертывания крови – на превращение фибриногена в фибрин, которой является основой кровяного сгустка.
Образование фибрина происходит в три этапa. Вначале образуется мембранносвязанный комплекс протеаз и белковых кофакторов, обладающий свойствами протромбиназы.
Затем протромбиназный комплекс превращает белок-предшественник протромбин в тромбин.
Тромбин, в свою очередь, действуя как фермент на фибриноген, превращает его в фибрин-мономер.
Полимеризация мономера в фибрин-полимер и образование в фибрин-полимере перекрестных сшивок под действием XIII фактора ведут к формированию фибриновой части тромба.
Он осуществляется как в ответ на повреждение тканей (внешний каскад), так и в ответ на контакт компонентов плазмы с полианионами (внутренний каскад).
ВНЕШНИЙ (или внесосудистый) механизм запускается с участием внешних (тканевых) факторов, ВНУТРЕННИЙ (или внутрисосудистый) – при участии факторов, источником которых служит сама кровь, плазма, собственно ферменты и форменные элементы крови.
При активации внешнего каскада роль мембранной подложки играет сосудистая стенка, а при реакциях внутреннего каскада — фосфолипиды мембран форменных элементов крови.
Оба каскада сходятся на ключевом этапе — активации Х фактора.
Предыдущая234567891011121314151617Следующая
Дата добавления: 2015-09-18; просмотров: 2232; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Предназначение обследований
Выявить нарушения в процессе свертывания крови позволяют специальные анализы. Они показывают, как работает система гемостаза. С помощью развернутого исследования можно определить нормально ли взаимодействуют свертывающая и противосвертывающая система.
По результатам расширенного обследования можно выявить:
- Коагулопатию: нарушение функционирования как противосвертывающей, так и свертывающей системы,
- Гиперкоагуляционно-тромботические состояния: при таких нарушениях появляются проблемы при беременности (это заболевание приводит к нарушению кровотока в плаценте, в результате плод начинает отставать в развитии, при тромбозе сосудов, питающих малыша, возможна внутриутробная гибель), повышается вероятность развития инфарктов, инсультов, тромбоза вен конечностей,
- Гипокоагуляционно геморрагические состояния: ухудшается процесс заживления ран, повышается вероятность внутренних кровотечений, во время операции возможно появление осложнений, развивается геморрагический диатез,
- Тромбо-геморрагические нарушения (ДВС синдром): в мелких сосудах начинается процесс тромбообразования, понапрасну расходуются компоненты свертывающей системы крови, это приводит к тому, что появившиеся кровотечения сложно остановить.
Рекомендуют оценивать работу свертывающей системы в следующих случаях.
- При проблемах с вынашиванием (более 2 замерших беременностей в анамнезе).
- В периоды перед и после оперативных вмешательств.
- При выявлении поражений печени и аутоиммунных заболеваний (ревматоидного артрита, красной волчанки, дерматомиозита).
- При варикозном заболевании, появлении тромбозов.
- После перенесенных инфарктов и инсультов.
- При развитии гемморагического диатеза.
- Для контроля работы свертывающей системы при приеме Аспирина, Курантила, Варфарина, Гепарина и других антикоагулянтных и антиагрегантных средств.
Данные анализы рекомендуют, если:
- Планируется прием гормональных контрацептивов женщинами,
- Наблюдается привычное невынашивание беременности,
- Требуется проведение заместительной гормональной терапии,
- Планируется эндопротезирование, гинекологические операции, трансплантации.
Также определить, нет ли мутаций, советуют пациентам, которые:
- Старше 50 лет и перенесли тромбоз,
- Имеют родственников, у которых в анамнезе есть инсульты, инфаркты, тромбозы, тромбоэмболии легочной артерии,
- Страдают от нарушений слуха неясной этиологии (в молодом возрасте),
- Перенесли длительную инфузионную химиотерапию.
Нарушение гемостаза
Проверяют наличие мутаций генов, отвечающих за функционирование свертывающей системы и метаболизм витамина В9.
При подозрении на проблемы рекомендуется сдать полный анализ. При таком исследовании определяют следующие показатели функционирования системы гемостаза.
Показатель; Характеристика
| Протромбин | Фактор, показывающий качество работы свертывающей системы. Стандартное значение от 78 до 142%. Более высокие показатели свидетельствуют об ускоренном свертывании, низкие – о появлении риска кровопотерь. |
| АЧТВ | Время, за которое сворачивается кровь. Норма: от 24 до 35 секунд. Сокращение времени свидетельствует о возможном ДВС-синдроме, удлинение – о риске кровотечений. |
| D-димер | Показатель, свидетельствующий о свертываемости крови. В норме значение не превышает 248 нг/мл, иначе говорят о повышенной склонности к тромбообразованию. |
| Волчаночный антикоагулянт | Свидетельствует об антифосфолипидном синдроме, в норме в расшифровке анализа должен отсутствовать. АФС повышает риск тромбозов. |
| Тромбиновое время | Отображает длительность заключительного этапа свертывания, длится от 11 до 18 секунд. |
| РКМФ | Считается первым маркером ДВС-синдрома. В норме отсутствует. |
| Антитромбин III | Белок крови, отвечающий за угнетение процессов свертывания крови. Значения колеблются в пределах от 70 до 115%. При понижении показателей риск появления тромбов возрастает, при повышении возникает вероятность развития кровотечений. |
Но говорить о проблемах можно лишь при условии, что пациент правильно сдал анализы. Как сдавать узнать желательно в лаборатории, в которую вы планируете обращаться. Основные правила подготовки едины: забор крови проводится натощак, запрещается с утра даже пить воду и чистить зубы.
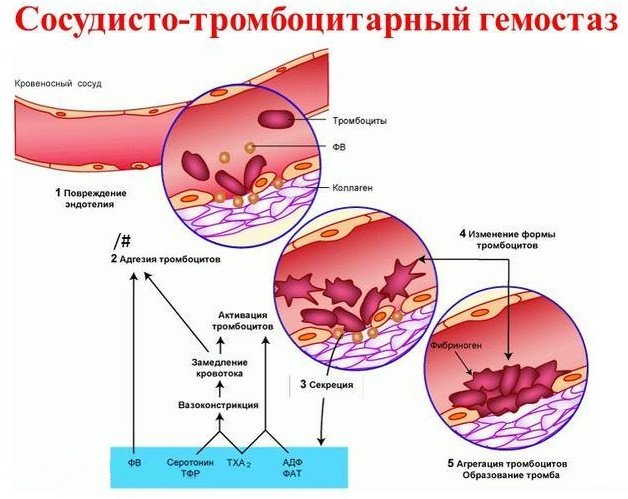
Сосудисто-тромбоцитный гемостаз