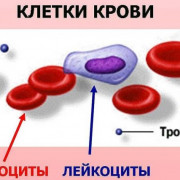
Ветви дуги аорты и зоны их кровоснабжения. дуга аорты
Содержание:
Классификация
Кардиологами принято различать две разновидности подобного врождённого дефекта:
- взрослую — является таковой при сегментарном стенозе просвета аорты ниже той части, от которой от него отходит левая подключичная артерия, а артериальный проток — закрыт;
- детскую — в таких ситуациях отмечается местное недоразвитие аорты аналогичной локализации, но артериальный проток открыт.
Основываясь на анатомических особенностях, известны такие формы недуга:
- изолированная — в таких ситуациях наблюдается лишь коарктация, без присутствия других отклонений. Является наиболее часто встречающимся типом, который диагностируется у 73% пациентов;
- сочетающаяся с ОАП — составляет лишь 5%;
- сопровождающаяся другими врождёнными пороками сердца, которые были указаны выше. Выявляется в 12% ситуаций.
Вторая разновидность болезни имеет свою классификацию и делится на:
- постдуктальную — локализуется ниже того места, где размещается открытый аортальный проток;
- юкстадуктальную — располагается на одном уровне с ОАП;
- предуктальную — открытый аортальный проток находится ниже коарктации аорты.
По мере своего прогрессирования заболевание проходит несколько периодов:
- критический — наблюдается у малышей, которым ещё не исполнился год. Отличается развитием сердечной недостаточности и высокой летальностью;
- приспособительный — отмечается у детей от 1 года до 5 лет. Основу клинической картины составляют лишь быстрая утомляемость и одышка;
- компенсаторный — выявляется в возрасте от 5 до 15 лет и зачастую протекает совершенно бессимптомно;
- относительной декомпенсации — развивается у больных в промежутке с 15 до 20 лет. Стоит отметить, что в период полового созревания снова появляются симптомы недостаточности;
- декомпенсации — такая коарктация аорты у взрослых 20-40 лет выражается в злокачественной гипертонической болезни, сердечной недостаточности, а также имеет высокий риск летального исхода.
В зависимости от места очага порока сердца существуют такие варианты протекания патологии:
- типичный — в зоне перехода дуги в нисходящую область;
- атипичный — в грудном и брюшном отделе.
Отдельно стоит выделить псевдокоарктацию аорты у новорождённого — это аналогичная коарктации деформация, однако она не препятствует потоку крови. Это обуславливается тем, что она является простой извитостью или удлинением дуги аорты.
Различают три типа коарктации аорты:
- I — изолированная коарктация аорты;
- II — коарктация аорты в сочетании с ДМЖП;
- III — коарктация аорты при сложных ВПС.
Расположение аневризмы аорты
Аневризмы аорты могут вызывать самые разные симптомы и проявления. Во многом это определяется расположением дефекта на сосуде. Чтобы лучше понять механизм появления этих симптомов, нужно иметь представление о том, что такое аорта и каково ее строение. Аорта берет начало в левом желудочке сердца. Оттуда в сосуд поступает артериальная кровь под большим давлением. Стенки аорты в норме должны гасить пульсацию при выбросе крови за счет эластичности стенок. Потеря этой эластичности ведет к образованию аневризм. На разном уровне от аорты отходят более мелкие сосуды – ее ветви. Если дефект захватывает устье этих ветвей, у пациента могут появляться самые разные симптомы, которые порой трудно связать с наличием аневризмы.
В брюшной полости аорта отдает следующие ветви:
- Диафрагмальные артерии. Это мелкие сосуды, число которых может несколько варьировать. Они питают нижние мышечные волокна диафрагмы.
- Чревный ствол. Это короткий непарный сосуд, который почти сразу после выхода из аорты делится на три крупные артерии, направляющиеся к желудку, печени и селезенке.
- Средние надпочечные артерии. Отходят вправо и влево к каждому надпочечнику.
- Верхняя брыжеечная артерия. Отходит вперед от аорты и делится на более мелкие ветви, которые питают различные участки тонкого кишечника.
- Почечные артерии. Также расходятся вправо и влево к почкам. Кровь поступает туда не только, чтобы питать орган, но и для очищения путем образования мочи.
- Артерии яичка/яичника. Направляются к половым железам. Количество этих сосудов и место их отхождения от аорты является индивидуальной особенностью организма. Также на это влияет пол пациента.
- Нижняя брыжеечная артерия. Делится на множество ветвей, питающих преимущественно толстый кишечник.
В грудной полости аорта отдает следующие ветви:
- Коронарные артерии. Данные сосуды небольшого диаметра отходят сразу после выхода аорты из левого желудочка и питают саму сердечную мышцу.
- Плечеголовной ствол. Сосуд впоследствии делится на правую подключичную артерию и правую общую сонную артерию.
- Левая общая сонная артерия. Поднимается по шее к голове и принимает участие в питании головного мозга.
- Левая подключичная артерия. Принимает участие в питании левой руки, плеча и прилежащих областей.
- Также имеется ряд более мелких артерий, питающих органы заднего средостения, межреберные мышцы, диафрагму и другие анатомические образования в грудной полости.
Поскольку образование аневризмы мешает нормальному току крови, страдать при данном заболевании могут любые органы, которые получают кровь от вышеперечисленных ветвей. Наиболее чувствителен к гипоксии (нехватке кислорода) головной мозг, поэтому аневризмы, затрагивающие плечеголовной ствол и левую общую сонную артерию обычно дают более ранние и выраженные симптомы.
Таким образом, положение аневризмы на аорте во многом предопределяет различные нарушения, которые и будут беспокоить пациента. При условии отсутствия болей аневризма на уровне чревного ствола, например, может проявляться плохим пищеварением, так как пострадает кровоснабжение желудка. Также расположение аневризмы предопределяет метод ее лечения. Для эффективного и безопасного хирургического решения проблемы врач должен четко представлять себе ее положение. В большинстве случаев при формулировке диагноза ветви аорты являются своеобразным ориентиром. Как пример можно привести инфраренальную аневризму аорты. Название указывает на то, что расширение сосуда расположено ниже места отхождения почечных артерий на брюшной аорте.
В целом же чаще всего говорят об аневризме брюшной или грудной аорты. Несмотря на то, что суть проблемы схожа (это расширения одного и того же сосуда на различных уровнях), симптоматика, лечение и прогноз для этих заболеваний различны.
Синусовый узел что это такое
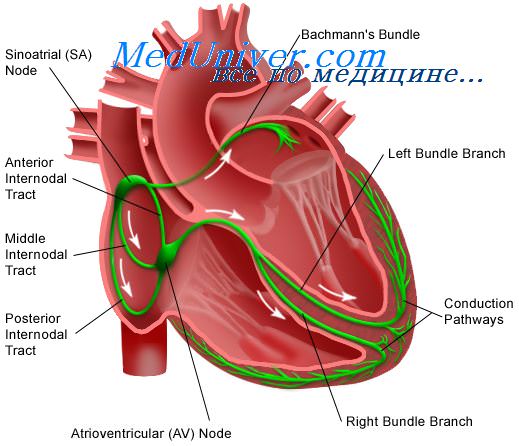
На рисунке показана схема проводящей системы сердца. В ее состав входят: (1) синусный узел (который также называют синоатриальным или С-А узлом), где и происходит ритмическая генерация импульсов; (2) предсердные межузловые пучки, по которым импульсы проводятся от синусного узла к агриовентрикулярному узлу; (3) атриовентрикулярный узел, в котором происходит задержка проведения импульсов от предсердий к желудочкам; (4) атриовентрикулярный пучок, по которому импульсы проводятся к желудочкам; (5) левая и правая ножки А-В пучка, состоящие из волокон Пуркинье, благодаря которым импульсы достигают сократительного миокарда.
Синусный (синоатриальный) узел представляет собой небольшую эллипсовидную пластинку шириной 3 мм, длиной 15 мм и толщиной 1 мм, состоящую из атипических кардиомноцитов. С-А узел расположен в верхней части заднебоковой стенки правого предсердия у места впадения в него верхней полой вены. Клетки, входящие в состав С-А узла, практически не содержат сократительных филаментов; их диаметр всего лишь 3-5 мкм (в отличие от предсердных сократительных волокон, диаметр которых 10-15 мкм). Клетки синусного узла непосредственно связаны с сократительными мышечными волокнами, поэтому потенциал действия, возникший в синусном узле, немедленно распространяется на миокард предсердий.
Автоматия — это способность некоторых сердечных волокон самостоятельно возбуждаться и вызывать ритмические сокращения сердца. Способностью к автоматии обладают клетки проводящей системы сердца, в том числе клетки синусного узла. Именно С-А узел контролирует ритм сердечных сокращений, как мы увидим далее. А сейчас обсудим механизм автоматии.
Механизм автоматии синусного узла. На рисунке представлены потенциалы действия клетки синусного узла, записанные на протяжении трех сердечных циклов, и для сравнения — одиночный потенциал действия кардиомиоцита желудочка. Необходимо отметить, что потенциал покоя клетки синусного узла имеет меньшую величину (от -55 до -60 мВ) в отличие от типичного кардиомиоцита (от -85 до -90 мВ). Это различие объясняется тем, что мембрана узловой клетки в большей степени проницаема для ионов натрия и кальция. Вход этих катионов в клетку нейтрализует часть внутриклеточных отрицательных зарядов и уменьшает величину потенциала покоя.
Прежде чем перейти к механизму автоматии, необходимо вспомнить, что в мембране кардиомиоцитов существуют три типа ионных каналов, которые играют важную роль в генерации потенциала действия: (1) быстрые натриевые каналы, (2) медленные Na+/Са2+-каналы, (3) калиевые каналы. В клетках миокарда желудочков кратковременное открытие быстрых натриевых каналов (на несколько десятитысячных долей секунды) и вход ионов натрия в клетку приводит к быстрой деполяризации и перезарядке мембраны кардиомиоцита. Фаза плато потенциала действия, которая продолжается 0,3 сек, формируется за счет открытия медленных Na+/Ca -каналов. Затем открываются калиевые каналы, происходит диффузия ионов калия из клетки — и мембранный потенциал возвращается к исходному уровню.
В клетках синусного узла потенциал покоя меньше, чем в клетках сократительного миокарда (-55 мВ вместо -90 мВ). В этих условиях ионные каналы функционируют по-другому. Быстрые натриевые каналы инактивированы и не могут участвовать в генерации импульса. Дело в том, что любое уменьшение мембранного потенциала до -55 мВ на срок больший, чем несколько миллисекунд, приводит к закрытию инактивационных ворот во внутренней части быстрых натриевых каналов. Большая часть этих каналов оказывается полностью блокирована. В этих условиях могут открыться только медленные Na+/Ca -каналы, и поэтому именно их активация становится причиной возникновения потенциала действия. Кроме того, активация медленных Na/Ca -каналов обусловливает сравнительно медленное развитие процессов деполяризации и реполяризации в клетках синусного узла в отличие от волокон сократительного миокарда желудочков.
Лечение
Лечение оперативное. Впервые успешную операцию при К. а. произвел Крафорд (С. Crafoord) в 1944 г. В СССР первую операцию выполнил E. Н. Мешалкин в 1955 г.
Показания к операции — все случаи диагностированной К. а. В раннем детском возрасте операция показана при развитии симптомов сердечной недостаточности. При благоприятном клин, течении порока оптимальным для операции является возраст 8—14 лет.
Противопоказания: эндокардит, свежий аортит, тяжелые поражения миокарда и паренхиматозных органов.
Рис. 4. Схематическое изображение наложения анастомоза конец в конец после резекции суженного сегмента аорты: 1 — аорта вместе с левой подключичной артерией пережата зажимами, артериальный проток пересечен, прошит и перевязан, пунктиром намечена граница резекции; 2 —резецирован суженный сегмент аорты; 3 — непрерывный шов задней стенки анастомоза; 4 — шов передней стенки анастомоза.
Рис. 5. Схематическое изображение операции по поводу коарктации аорты с применением синтетической ткани: а — замещение сегмента аорты синтетическим протезом; б — истмопластика «заплатой» из синтетической ткани; 1 — аорта, 2 — левая подключичная артерия, 3 — медиастинальная плевра, 4 — синтетический протез, 5 — «заплата» из синтетической ткани.
Техника операции. Разработаны следующие методы устранения сужения аорты: 1) резекция аорты с анастомозом конец в конец (рис. 4); 2) резекция с протезированием аорты аллопротезом или другим трансплантатом; 3) истмопластика прямая и непрямая (рис. 5); 4) шунтирование.
Наиболее оправданы методы резекции с анастомозом конец в конец или резекция с протезированием грудной аорты, дающие лучший гемодинамический эффект. У детей необходимо использовать резекцию с анастомозом конец в конец или в случаях гипоплазии престенотического участка — пластику за счет левой подключичной артерии. При этом для предупреждения развития синдрома ретроградного кровотока по левой позвоночной артерии ее следует перевязывать.
Операцию проводят в условиях интубационного наркоза с применением ганглиоблокаторов, которые позволяют проводить управляемую гипотонию, что уменьшает кровопотери), устраняет опасность подъема АД на период пережатия аорты п уменьшает опасность ишемического повреждения спинного мозга, почек и печени. У больных с плохо развитыми коллатералями при патол, градиенте давления на руках и ногах не выше 40 мм рт. ст. следует использовать специальные методы защиты спинного мозга и органов брюшной полости: умеренную общую гипотермию (30—32°), обходное шунтирование из левого предсердия в бедренную артерию. Подход к аорте осуществляют путем заднебоковой торапотомии по IV или V межреберью.
При рассечении мягких тканей необходимо провести тщательный гемостаз из-за выраженного развития коллатералей. Медиастинальную плевру рассекают над аортой и левой подключичной артерией, выделяют пре- и постстенотический отделы аорты. Межреберные артерии (первые две пары) при необходимости выделяют, перевязывают и пересекают. Перевязывают и пересекают открытый артериальный проток. Далее объем операции зависит от характера порока. При наложении анастомоза конец в конец у детей раннего возраста применяют отдельные П-образные швы, что обеспечивает рост анастомоза в последующем. Герметичность анастомоза проверяют при высоком АД.
Осложнения операционного и послеоперационного периодов. Во время операции после восстановления кровотока по аорте возможна гипотензия, к-рую предупреждают прекращением введения ганглиоблокаторов и инфузией крови и жидкостей для поддержания должного минутного объема сердца. В ближайшем послеоперационном периоде, чаще у детей, может наблюдаться парадоксальная гипертензия. Для лечения этого осложнения используют пентамин, арфонад или бета-блокаторы (обзидан). В послеоперационном периоде может развиться абдоминальный синдром — резкие боли в животе, симптомы раздражения брюшины, высокий лейкоцитоз.
Лечение в большинстве случаев медикаментозное, направленное на ликвидацию высокой артериальной гипертензии. При нарастании лейкоцитоза, явлений перитонита, возникающего в связи с регионарным нарушением кровообращения (тромбоз, эмболия), показана лапаротомия.
Кровотечение в ближайшем послеоперационном периоде встречается в 4—7% случаев. При истечении большого количества крови по дренажу из плевральной полости, снижении уровня гемоглобина показана реторакотомия с целью остановки кровотечения.
Диагностика
Диагностика включает в себя опрос, объективное, лабораторное и инструментальное обследования.

- Опрос и осмотр. Анамнез – стенокардия, генетические заболевания, осложненная наследственность. При осмотре — бледность кожи, покраснение и одутловатость лица и шеи, набухание шейных вен;
- Объективное обследование. Локальная боль за грудиной на уровне 2-5 межреберий. Перкуторно – границы сердца смещены по проекции аневризмы. Аускультативно – непрерывный или диастолический шум (сопутствующая аортальная недостаточность);
- Рентгенография. Тень восходящего отдела искривлена, косо поднимается в сторону верхушки правого легкого. При мешотчатых аневризмах выявляется дополнительная круглая дуга. Возможно обнаружение кальцинатов;
- ЭКГ. Повышение вольтажа зубца R, подъем ST, тахикардия, эстрасистолы. При поздней диагностике — признаки инфаркта (зубец Q, подъем зубца Т);
- Лабораторные данные. Умеренный лейкоцитоз, повышение СОЭ. При развитии инфаркта – повышение АЛТ, АСТ, миоглобина, тропонина, МВ-КФК, ЛДГ;
- ЭхоКГ. Увеличение диаметра восходящего отдела более 3.5-4 см, сопутствующая аортальная недостаточность (обратный заброс крови), спазм коронарных артерий, тромбы;
- Аортография. Деформация контура восходящего отдела, мешотчатое выпячивание, связанное с аортой. При расслоении – ложный канал кровотока, пристеночная гематома;
- КТ (МРТ). Определение точных размеров аневризмы, толщины ее стенки, выявление тромба, отека мягких тканей.
7 Лечение
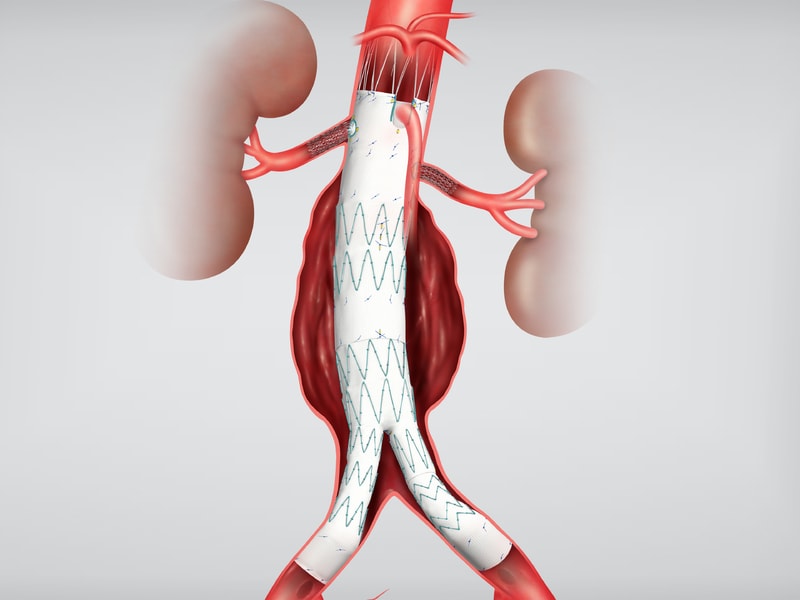
Единственным способом лечения аневризмы на сегодняшний день является хирургическое. Оно проводится несколькими способами:
1. Открытые хирургические операции:
- Иссечение кровеносного сосуда и установка протеза.
- Бифуркационное аорто-бедренное шунтирование. На боковой стенке живота делают разрез, брюшину отодвигают в сторону для получения доступа к аорте и устанавливают шунт.
- Бифуркационное аорто-бедренное протезирование, при котором используется синтетический протез.
2. Внутрисосудистая хирургия:
- Имплантация линейного искусственного сосуда.
- Имплантация раздвоенного сосуда в области бифуркации.
3. Гибридные операции, сочетающие несколько видов воздействий, указанных выше.
Аорто-бедренное шунтирование
Открытые операции могут проводиться у пациентов с благоприятным хирургическим прогнозом и состоянием здоровья, а также показаны тем больным, у которых аневризма достигает значительных размеров, что требует изготовления индивидуального эндопротеза.
Внутрисосудистое шунтирование и протезирование применяется при высоком риске осложнений со стороны сердечно-сосудистой или дыхательной системы.
Основными показаниями для проведения операции являются следующие:
- Диаметр аневризмы у мужчин 5 см и более, у женщин – больше 4,5 см.
- Рост аневризмы со скоростью более 6 мм за 6 месяцев вне зависимости от ее размера.
- Наличие факторов риска разрыва сосуда.
- Расположение тромба в аневризматическом мешке.
- Острая закупорка сосуда тромбом.
- Наличие дочерних аневризм.
- Признаки разрыва аневризмы у больного.
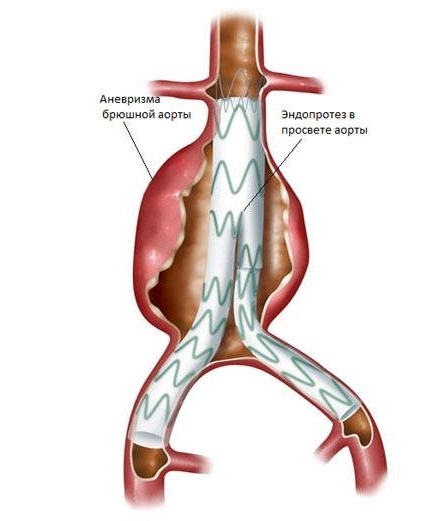
Эндопротезирование
При меньших размерах аневризм показано ежегодное ультразвуковое обследование.
Противопоказаниями для проведения хирургического вмешательства являются следующие:
- инфаркт миокарда, произошедший за 3 месяца до плановой операции по поводу аневризмы;
- острое нарушение мозгового кровообращения сроком менее 1,5 месяца;
- легочная недостаточность в тяжелой стадии;
- выраженная почечная или печеночная недостаточность;
- злокачественные опухоли в последней стадии.
В предоперационный период больным показан прием следующих лекарственных препаратов:
- статинов (Флувастатин, Лескол и другие) за 30 дней — для снижения риска ишемической болезни сердца, инфарктов миокарда и других сердечно-сосудистых осложнений во время операции и после нее;
- бета-блокаторов за 1 месяц — при наличии в анамнезе больного сердечно-сосудистых заболеваний.
Количество летальных исходов после планового хирургического вмешательства составляет около 5% от общего числа прооперированных. Успешность лечения зависит от возраста пациента и имеющихся сопутствующих патологий сердца, почек, дыхательной системы. Число негативных последствий значительно сокращается при отказе больного от курения за 2-3 месяца до операции.
Оперативное лечение аневризмы брюшной аорты может иметь следующие осложнения:
- аритмия (3% всех прооперированных);
- инфаркт миокарда (1%);
- сердечная недостаточность (1%);
- пневмония (3%);
- почечная недостаточность (2%);
- закупорка легочной артерии (0,2%);
- сепсис (0,7%);
- инсульт (0,4%);
- кишечная непроходимость (2%);
- кровотечение в забрюшинное пространство (0,4%).
Патологическая анатомия, патогенез
Рис. 1. Гигантская сифилитическая аневризма аорты
По механизму развития аневризмы подразделяют на истинные (aneurisma verum), связанные с нарушением нормальной структуры стенки аорты, ложные (aneurisma spurium), представляющие собой пери-аортальную гематому, и расслаивающие. Аневризмы бывают диффузные и ограниченные. Первые выглядят как значительное расширение просвета аорты разной длины, иногда до 10 см, веретенообразной или цилиндрической формы. Ограниченные аневризмы представляют собой очаговые выпячивания стенки аорты мешковидной, ладьевидной, воронкообразной формы. Величина их различная, до размера головы ребенка (рис. 1). Входное отверстие аневризмы овальной или щелевидной формы с ровными краями, имеет малые размеры или равно диаметру аневризмы.
Рис. 2. Атеросклеротическая аневризма брюшной аорты с пристеночным тромбозом
Встречаются множественные, обычно мешковидные аневризмы; возможны варианты комбинированных аневризм на одном участке аорты. Внутренняя поверхность аневризмы редко остается гладкой, обычно она бугристая, со вторичными атеросклеротическими и гиперпластическими изменениями, покрыта тромбами (рис. 2), которые могут целиком заполнить небольшую аневризму. Окраска на эластин выявляет участие структур стенки аорты в формировании аневризмы. Соединительнотканный каркас и мышечные элементы стенки аорты могут резко обрываться на границе с аневризмой и замещаться рубцовой тканью. Лишь в стенке небольших аневризм остаются истонченные эластические волокна. В старых аневризмах внутренний слой формируется заново с образованием эластических волокон. Наружный слой состоит из соединительной ткани с наличием лимфоцитарных инфильтратов.
Сифилитические аневризмы являются закономерным исходом сифилитического мезаортита, сохраняют его морфологические черты, имеют чаще мешковидную, реже веретенообразную форму.
Большие аневризмы восходящей аорты и ее дуги вызывают узуру грудины и прилежащих частей ребер, сдавление левого возвратного гортанного нерва (с картиной паралича левой голосовой связки), плечевого сплетения, крупных шейных нервов, симпатических шейных узлов, верхней доли левого легкого, трахеи, крупных бронхов с явлениями бронхита.
Аневризмы грудной аорты часто ведут к узуре позвонков с картиной поперечного миелита от сдавления спинного мозга, изредка возможно сдавление пищевода.
При резко выраженном атероматозе аорты с атрофическими и деструктивными изменениями средней оболочки создаются предпосылки для расширения аорты в виде диффузной ее аневризмы. Ложные травматические аневризмы представляют собой пери- и параортальную гематому. В процессе уплотнения и организации фибрина формируется фиброзная стенка с расположенными вокруг инфильтратами из лимфоидных и гистиоцит арных клеток. В дальнейшем развиваются эластические волокна, разрастается интима и эндотелий, выстилающий мешок преимущественно около «шейки» аневризмы.
Микотические эмболические аневризмы аорты возникают при септическом язвенном аортите (см.) в случаях sepsis lenta, когда локализация инфицированных тромбов на интиме вызывает некротические и воспалительные процессы в стенке. Не исключена возможность эмболии vasa vasorum. При быстром разрушении стенки формируется небольшая аневризма со склонностью к разрыву, однако известно и хроническое течение таких аневризм. Аррозионные аневризмы развиваются вследствие перехода воспаления из очагов гнойного периостита, туберкулезного спондилита и лимфаденита на стенку аорты с разрушением наружной и части средней оболочки и выпячиванием оставшихся слоев наружу. В их стенке обнаруживают туберкулезные грануляции, казеозные массы.
Веретенообразная аневризма аорты, наблюдается в области артериальной связки. Аневризма синусов аорты локализуется чаще в правом синусе, тонкая стенка которого служит продолжением septum membranaceum, в связи с чем возможен прорыв в правый желудочек.
Причины и механизм развития
Причины:
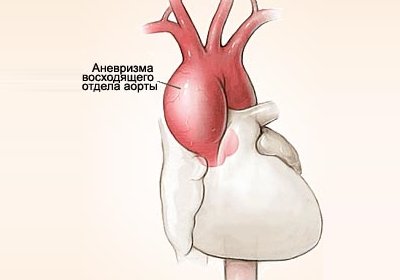
- Атеросклероз (80%);
- Генетические синдромы (Данло-Элерса, Тернера, Лойеса-Дитца, Марфана);
- Семейная наследственная аневризма;
- Синдром артериальной извитости;
- Аневризмо-остеоартрит;
- Гипертоническая болезнь;
- Сифилис;
- Аортоартериит.
Независимо от природы в аорте развиваются воспалительно-дистрофические явления: стенка истончается, вытягивается и деформируется. Высокая скорость кровотока приводит к ее дополнительной травматизации.
Под действием передаточного давления с левого желудочка наиболее слабый участок восходящего отдела растягивается и выпячивается, что и называется «аневризмой».